Esse experimento está baseado em dois espectrógrafos que temos no Laboratório, que permitem analisar a) a luz visível com alguns espectros na região ultra violeta e b) a luz visível com alguns espectros na região do infra vermelho. Vamos estudar o espectro do Hidrogênio, em particular a série de Balmer e obter a constante de Rydberg. Essa montagem nos permite estudar também a Lei de Wien, através do qual estaremos aptos a estimar a temperatura do sol.Também estudaremos qualitativamente as cores de um monitor de computador. E por fim os semicondutores que produzem luz- os LEDs.
O espectrógrafo do Lab
Basicamente a luz da fonte que escolhemos analisar é captada por uma fibra óptica que conduz a uma grade de difração e que sensibiliza uma CCD (Charge-Coupled Device), um sensor semicondutor para captação de comprimentos de onda formado por um circuito integrado que contém uma matriz de capacitores acoplados. É esse dispositivo que digitaliza os comprimentos de onda, que aparecem na tela do computador num gráfico de intensidade por comprimento de onda (nm ou Å).

As lâmpadas especiais que usamos neste experimento contem elementos e substâncias específicos
Com uma tensão da ordem de 5 mil Volts temos uma luz específica que permite uma análise espectrográfica
A fibra óptica é o meio de captar a luz visível

Os espectrógrafos que usamos no Laboratório são da Ocean Optics e são fáceis de manipular
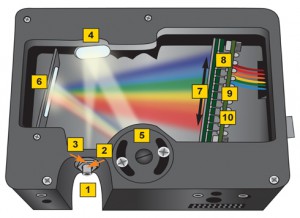
Uma visão demonstrativa do percurso da luz no interior do equipamento de 1 a 3 mostra a conexão com o cabo da fibra óptica; 4 e 6 são espelhos; 5 é a grade de difração; 7-10 são as partes do CCD para digitalizar as comprimentos de onda.
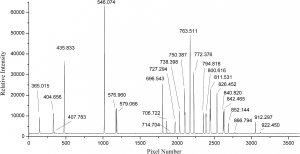
A primeira ação dos alunos deve ser calibrar o sistema para que a leitura seja confiável e possa ser generalizada para todas as fontes de radiação de comprimentos de onda no intervalo da grade do equipamento. Para isso usamos uma fonte de Ar-Hg, que tem seus cumprimentos de onda conhecidos e fornecidos aos alunos.
A calibração é feita a partir da captação dos comprimentos de ondas da lâmpada de Mercúrio-Argônio similar à figura acima. Os valores de λT da tabela acima deverão ser associados aos pixels obtidos pelo software. Assim forma-se uma série de pontos (p, λT) que quando colocados num gráfico podem ser interpolados por um polinômio de terceiro grau como:
λ = C1 + C2 p + C3 p2 + C4 p3
E assim obtemos a constantes Ci com i = 1…4. Há uma janela no software que estas constantes podem ser inseridas e completa-se a calibração. Para aferir se a calibração está razoável capta-se o laser He-Ne de λ= 632,8 nm . O aluno deverá dizer se a eventual discrepância é razoável ou não para seguir com o experimento. Se não, aconselha-se retomar o procedimento da calibração.
Estudo do Hidrogênio
Quando colocamos uma lâmpada de Hidrogênio para análise, verificamos que seu espectro é de linhas discretas em valores específicos de comprimentos de onda. A explicação exata é fornecida pela teoria quântica Em seu modelo do átomo de hidrogênio em 1913, Bohr mostrou que a série de linhas observadas poderia ser explicada se assumimos que os elétrons estão restritos a órbitas atômicas nos quais seu momento angular orbital é um múltiplo inteiro da quantidade
[latex] \hbar \quad =\quad \frac { h }{ 2\pi } [/latex] , onde h é a constante de Planck.
Os múltiplos inteiros (por exemplo, 1, 2, 3 …) de [latex] \hbar\quad [/latex] é representado pelo símbolo n e geralmente é chamado de número quântico. Quando um elétron decai de uma órbita de maior energia para outra de menor energia, então um fóton de uma determinada frequência ν é emitido, seguindo a seguinte relação:
[latex] \nu \quad=\quad \frac { \Delta E }{ h } [/latex]
No caso do Hidrogênio, ν = c/λ , onde 1/λ é dado por:
[latex]\frac { 1 }{ \lambda } =R\left[ \frac { 1 }{ { n }_{ f }^{ 2 } } -\frac { 1 }{ { n }_{ i }^{ 2 } } \right][latex]
onde R é a constante de Rydberg, nf e ni são os números quânticos da órbita do elétron (observe que sempre nf < ni ).
Quando nf = 1 temos a série de Lyman; quando nf = 2 temos a série de Balmer; quando nf = 3 temos a série de Paschen; quando nf = 4 temos a série de Brackett; quando nf = 5 temos a série de Pfund
A teoria de Bohr não foi tão boa, no entanto, para explicar os espectros de substâncias –outros desenvolvimentos posteriores da teoria quântica mostraram que todos os aspectos de espectros atômicos e moleculares podem ser explicados quantitativamente em termos de transições de energia entre diferentes estados quânticos permitidos.
No laboratório podemos checar estes desenvolvimentos teóricos, pois temos como medir de forma muito cômoda os comprimentos de onda do Hidrogênio. Portanto podemos verificar se obtemos por meios das contas a constante de Rydberg. É necessário que a partir dos erros estimados para cada comprimento de onda, fazendo a devida propagação, possamos estimar o erro da constante de Rydberg.
Lei de Wien
O espectrógrafo que temos também permite que estudemos de forma muito prática a Lei de Wien.
O alemão Wilhelm Wien recebeu o Nobel de Física de 1911 pela descoberta da lei que relaciona a temperatura do corpo negro (corpo ideal que recebe e emite todas as frequências de luz) , e o o maior comprimento de onda emitido. Foi dele a ideia de que um forno com um orifício seria um boa aproximação para o corpo negro ideal. Qualquer radiação que entra no pequeno furo é dispersa e refletida nas paredes internas do forno tantas vezes que quase toda a radiação que entra é absorvida e é extremamente pequena a chance de alguns dos comprimentos de onda de encontrar o seu caminho para fora do buraco de novo. A radiação que efetivamente sai desse buraco é, então, muito próxima equilíbrio do corpo negro, ou seja, da radiação eletromagnética que correspondente à temperatura do forno.
Empiricamente, Wien chegou à seguinte formulação:
[latex]{ E }_{ f }(f,T)\quad =\quad { f }^{ 3 }F(f/T)[latex]
Interessante que através de suas experimentações ele descobriu que deveria ser uma função proporcional ao cubo de f e que estaria associada à razão entre f e T. O trabalho experimental, no entanto, não se limita a descobrir uma função Ef(f,T), mas a Eλ(λ,T), pois está focado em determinar o comprimento de onda máximo (λmáx). Assim podemos associar que: [latex]{ E }_{ f }(f,T)df=\quad { E }_{ \lambda }(\lambda ,T)d\lambda[latex]
mas, como sabemos a velocidade da luz c= f.λ, donde resulta que [latex]df=-\frac { c }{ { \lambda }^{ 2 } } d\lambda[latex]
[latex]\quad { E }_{ \lambda }(\lambda ,T)=\frac { df }{ d\lambda } { E }_{ f }(f,T)=-\frac { c }{ { \lambda }^{ 2 } } { E }_{ f }(f,T)[latex]
Usando a proposta de Wien, temos que:
[latex] \quad { E }_{ \lambda }(\lambda ,T)=-\frac { { c }^{ 4 } }{ { \lambda }^{ 5 } } F(c/\lambda T)[latex]
O sinal negativo indica que uma diminuição do comprimento de onda significa um aumento da frequência, portanto nesta formulação podemos desconsiderá-lo, se consideramos a variação dλ>0. E para acharmos o comprimento de onda onde haja máxima emissão, precisamos derivar Eλ em relação a λ e igualar a zero:
[latex]\quad \frac { \partial { E }_{ \lambda }(\lambda ,T) }{ \partial \lambda } =\frac { { c }^{ 4 } }{ { \lambda }^{ 5 } } \left\{ \frac { -5 }{ \lambda } F(\frac { c }{ \lambda T } )-\frac { c }{ { \lambda }^{ 2 }T } F'(\frac { c }{ \lambda T } ) \right\} =0[latex]
Observamos que o λmáx só existirá se se impor esta restrição:
[latex]T.\quad \lambda \quad =\quad C\quad \quad \quad (onde\quad C\quad =\quad uma\quad constante)[latex]
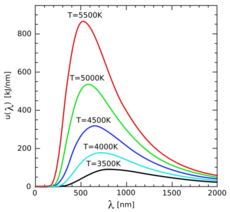
T é a temperatura (em Kelvin), λ é o comprimento de onda mais intenso (em nm) e C = 2,89776829 . 106 nm x K
Portanto, o aluno deverá analisar uma lâmpada comum em diferentes potências, usando um variac e captar o comprimento de onda máximo, observando que ele se desloca para valores menores conforme o aumento da potência. Usando a relação de Boltzmann podemos inferir a temperatura e estimar qual seria a constante nas condições do nosso laboratório. Como exercício podemos captar a luz solar e ver seu espectro e estimar a sua temperatura. Comente as discrepâncias entre os valores da literatura e o obtido no laboratório para a constante da Lei de Wien.
O pico máximo é deslocado para a esquerda, quando a temperatura aumenta.
Um olhar qualitativo sobre as cores do monitor
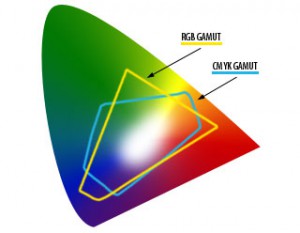
o espectrógrafo que dispomos permite uma análise qualitativa sobre os comprimentos de onda básicos que estão na tela do computador. O sistema é chamado RGB, iniciais das palavras red, green, blue ( ou vermelho, verde e azul) que devidamente combinados dão todas as variedades de tons de cores do espectro visível na tela do computador. A totalidade de tonalidades de cor (range, gamut) que o ser humano consegue distinguir, definem um leque espectral bastante grande. Deste “espaço de cor”, os sistemas RGB e CMYK só conseguem reproduzir uma parte.
Pode-se obter o espectro das cores básicas usando um programa de desenho (Paint Brush) e ver as múltiplas cores na tela de computador. A intensidade varia de 0 a 255 para os tons de verde , vermelho e azul. Todas as tonalidades de cor estão associadas a estas combinações nestes intervalos.
É possível também estudar a ação de filtros sob as várias cores e verificar como se comportam seus espectros antes e depois da ação de filtragem.
Existem vários modelos de cor: RGB, CMYK, LAB, etc. Uma grande parte do espectro visível aos humanos pode ser representada misturando-se luz vermelha, verde e azul (Red, Green, Blue) em diferentes proporções e intensidades.
Semicondutores e LED
Famílias de semicondutores pode ser incorporadas em dispositivos que emitem luz numa grande parte do espectro visível, após excitação elétrica. Estes diodos emissores de luz (LEDs) e lasers de diodo estão revolucionando muitas tecnologias de comunicação e de exibição. Os comprimentos de onda da luz emitidos podem ser controlados usando os princípios de design com base na tabela periódica, incluindo combinações de elementos de mesma valência e soluções sólidas. Um recente avanço tecnológico é o LED azul, que permite obter uma gama de cores adicionais quando combinado com LEDs de cor verde e vermelha.
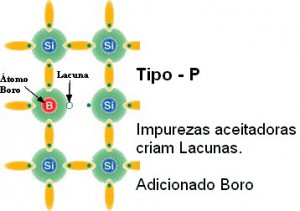
Semicondutores são tipicamente preparados a partir de combinações de elementos que têm estruturas cristalinas relacionadas com a do Carbono, Silício, Germânio, etc. e que tenham o mesmo número médio de elétrons de valência por átomo como os átomos vizinhos destes elementos na tabela periódica. Vejamos o caso padrão que é o Silício dopado com Boro e com Fósforo, que resultam materiais com características bem interessantes para desenvolver materiais semicondutores.
|
Estrutura cristalina de átomos de Silício, mas com átomos de Boro como “impurezas”. Observe que há “lacunas” de elétrons por causa da valência do Boro. Esse material é chamado tipo P. |
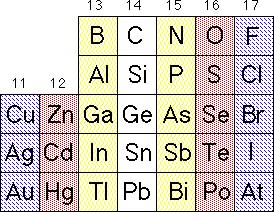
O segmento da tabela periódica acima indica os grupos de átomos que são preferencialmente utilizados para desenvolver materiais semicondutores, aqueles que tem valências próximas. |
|
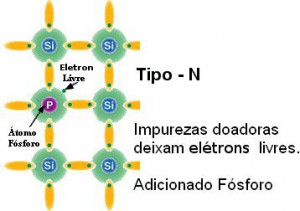
Nesta figura vemos a mesma estrutura cristalina do silício agora com a presença de átomos de Fósforo, que contém um elétron a mais, conforme se vê na tabela periódica. Portanto, os materiais assim produzidos são chamados tipo N. |
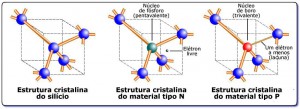
Uma visão comparativa da estrutura cristalina do silício, do material tipo N e do material tipo P. |
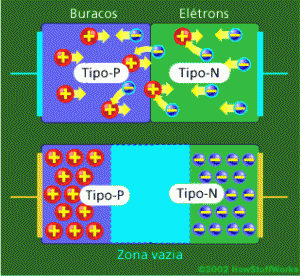
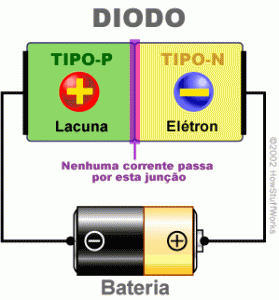
Um semicondutor com junção de material P e N, observe que cria uma espécie de zona vazia |
||
|
No entanto, com uma inversão de polaridade na bateria, podemos observar que a corrente é interrompida, fazendo com o semicondutor funcione como diodo. |
||
|
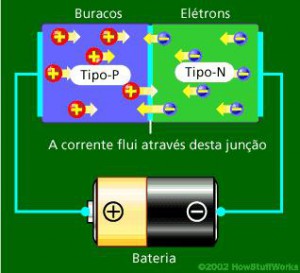
Uma simples bateria, com a polarização adequada pode fazer fluir uma corrente de elétrons neste semicondutor. |
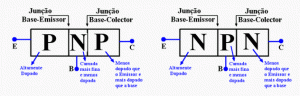
O conceito de justaposição de material tipo P e N deu origem aos transistores que tem a seguinte característica:
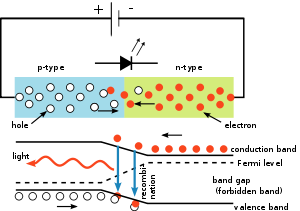
Mas seu estudo foge do escopo da nossa experiência, por isso precisamos nos voltar para a junção PN que gera luz, ou seja, os LEDs que tem a seguinte estrutura:
Podemos captar os vários comprimentos de onda dos LEDs disponíveis no Laboratório e fazer um estudo qualitativo de como funcionam os semicondutores. Quando banhamos o LED em líquido criogênico, podemos observar que sua temperatura muda abruptamente, assim como o espectro de luz que emite. E inferir como podem funcionar células solares baseadas em semicondutores para obter energia do sol.